Por Marta Bruguera Bonfill, Global Technical Lead Swine en Agrifirm.
Las endotoxinas son compuestos tóxicos que se liberan de la membrana externa de la pared celular de las bacterias gramnegativas durante su lisis. Las bacterias gramnegativas pueden causar daños por sí mismas, pero también por las endotoxinas que liberan. La barrera intestinal es la primera línea de defensa del organismo, protegiéndolo de la principal fuente de endotoxinas, el contenido intestinal. En el momento del destete, los lechones se convierten en los animales más vulnerables a las endotoxinas, debido a su inmadurez digestiva y a los múltiples factores de estrés que comprometen la funcionalidad de su barrera intestinal y el equilibrio de su microbiota intestinal.
El organismo del lechón reconoce las endotoxinas como un cuerpo extraño lo que desencadena una respuesta inflamatoria. Esta respuesta, en los casos más leves, reduce el crecimiento y el rendimiento del lechón debido a la utilización de nutrientes para satisfacer las necesidades del sistema inmunitario. En los casos más graves, la respuesta inmunitaria a las endotoxinas degrada el rendimiento y provoca fiebre, inflamación sistémica, reducción del consumo de pienso, aumento de la permeabilidad intestinal y trastornos digestivos. Estos síntomas se producen cuando aumenta la permeabilidad intestinal, lo que permite que las endotoxinas entren en la circulación sistémica y linfática. Además, cuando se supera la capacidad de detoxificación del organismo, el lechón muere por endotoxemia, shock y fallo multiorgánico.
Se puede adoptar una amplia gama de medidas indirectas para contrarrestar los efectos de las endotoxinas. Entre ellas se incluyen estrategias para reducir la presencia de bacterias gramnegativas y el estrés, y para mejorar la integridad intestinal y la madurez de los lechones. Sin embargo, en la actualidad, mientras que existen métodos de control directo de los efectos tóxicos de las endotoxinas para los seres humanos, sólo unas pocas estrategias son económicamente viables para los cerdos.
El destete es el momento más crítico
El momento más crítico para el lechón es el destete, cuando múltiples factores de estrés comprometen su rendimiento y su salud. La separación del lechón de su madre, y el cambio de una dieta líquida (leche) a otra sólida (pienso), son cambios bruscos que generan un gran estrés. Otras circunstancias, como el transporte, la mezcla de animales, el establecimiento de nuevas jerarquías sociales, el cambio de ambiente, el manejo y la adaptación a nuevos comederos y bebederos, se suman al estrés. Además, la implementación de programas de vacunación y la presencia de patógenos, entre otros factores, hacen del destete el periodo de mayor exigencia y, a su vez, de mayor riesgo para el lechón.
En el momento del destete, el tracto gastrointestinal (TGI) del lechón aún no está completamente desarrollado y presenta una capacidad limitada para la digestión y absorción de nutrientes. Esto se ve agravado por la reducción del consumo de agua y pienso tras el destete, que induce cambios en la morfología y funcionalidad del TGI del lechón.
Microbiota intestinal
La microbiota intestinal desempeña un papel determinante en funciones específicas del metabolismo de los nutrientes, la inmunidad y la preservación de la integridad de la barrera mucosa intestinal. Por lo tanto, es importante mantener un equilibrio en este sentido.
Las condiciones fisicoquímicas varían en las distintas partes del TGI, por lo que la población microbiana que habita en cada zona también es diferente. El intestino delgado y el grueso son zonas de colonización preferente por patógenos bacterianos oportunistas. No obstante, se necesitan más estudios para conocer específicamente la composición de la microbiota en todo el TGI y los mecanismos de disbiosis para su prevención. En general, podemos decir que es importante mantener un equilibrio entre bacterias grampositivas y gramnegativas. El estrés del destete, junto con la inmadurez del TGI del lechón, la reducción del consumo y el cambio de dieta, se asocian con alteraciones en el equilibrio de la microbiota intestinal, diarrea, mayor susceptibilidad a infecciones entéricas, uso de antibióticos y reducción del rendimiento. Esta disbiosis intestinal puede correlacionarse con una gran proliferación de bacterias gramnegativas como las enterobacterias (por ejemplo, E. Coli, Salmonella spp.) que desplazan a la microbiota intestinal beneficiosa (como los Lactobacillus, entre otros), causando enfermedades como la colibacilosis o la salmonelosis.
Bacterias gramnegativas y endotoxinas
Las bacterias gramnegativas pueden causar daños por sí mismas, pero también por las endotoxinas que liberan. A diferencia de las bacterias grampositivas, que no tienen membrana externa, las bacterias gramnegativas tienen una estructura característica de envoltura celular que las protege. Las bacterias gramnegativas están rodeadas por la membrana citoplasmática interna, una fina pared celular de peptidoglicanos y otra membrana externa que contiene fosfolípidos, proteínas de membrana y lipopolisacáridos (LPS) (véase la figura 1).
Los LPS en su forma libre se denominan endotoxinas debido a su toxicidad y capacidad para inducir una respuesta inmune en el animal cuando entran en la circulación sistémica (aunque ambos términos se utilizan indistintamente en la bibliografía).
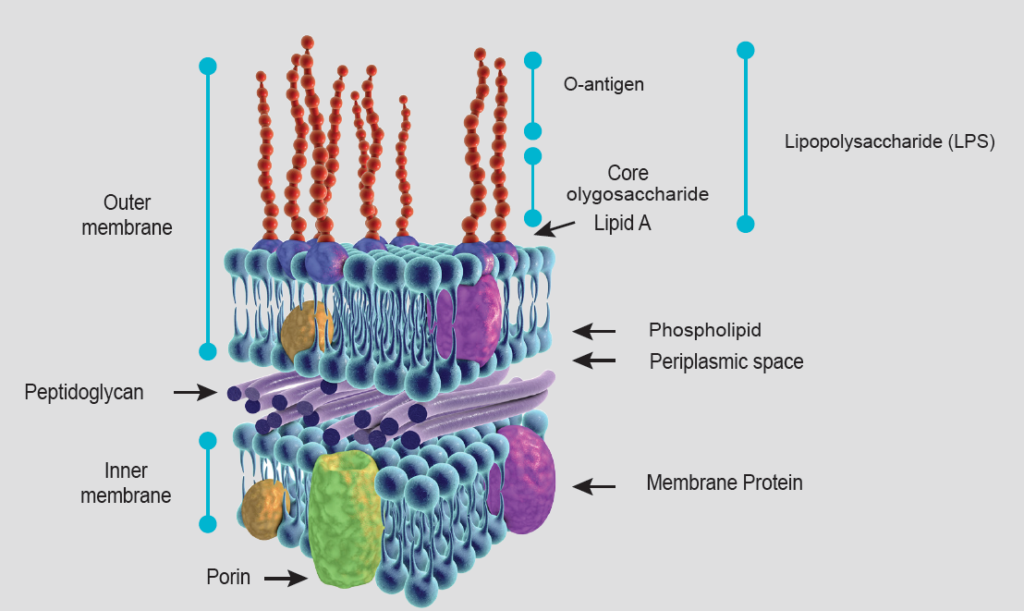
El LPS consta de 3 elementos estructurales: el lípido A, el núcleo de oligosacáridos y el antígeno-O (Figura 1). El lípido A actúa como elemento de anclaje del LPS a la membrana externa de la bacteria (componente hidrofóbico). Es responsable de la mayor parte de la toxicidad causada por las endotoxinas, y su estructura y toxicidad pueden variar entre especies bacterianas. El antígeno-O, también denominado antígeno O-(específico), es una cadena de oligosacáridos de composición variable en función de la especie y cepa de bacteria gramnegativa, y se encuentra en la parte extracelular (componente hidrofílico). Es altamente inmunogénico y estimula la producción de anticuerpos, aunque estos no protegen contra los efectos tóxicos del LPS, ya que esta parte no es patógena.
Liberación y fuentes de LPS
Los LPS se desprenden de las bacterias gramnegativas durante la lisis celular. Esto ocurre durante la replicación y muerte celular, así como en el contacto de la bacteria con el agua. La muerte bacteriana puede producirse por la acción del sistema inmunitario o cuando utilizamos antibióticos, especialmente β-lactámicos. La tasa de liberación de LPS varía entre las distintas especies y cepas de bacterias. Como las endotoxinas provienen de bacterias gramnegativas, son ubicuas en el medio ambiente. Pueden encontrarse en el agua, los piensos, el suelo y el aire, pero la fuente principal está en el tracto gastrointestinal y las heces.
En el TGI, las endotoxinas están mayoritariamente presentes en el intestino grueso, principalmente procedentes de bacterias gramnegativas de la familia Enterobacteriaceae, como E. Coli y Salmonella spp. Estas pueden excretarse en las heces, contaminar partículas de polvo y, posteriormente, transmitirse mediante aerosoles que, al ser inhalados por los animales, pueden provocar inflamaciones y enfermedades respiratorias o gastrointestinales. La barrera intestinal es la primera línea de defensa del organismo, que lo protege de la mayor fuente de LPS, el contenido intestinal. Los lechones al destete son los animales más vulnerables a las endotoxinas. Esto se debe a su inmadurez digestiva y a los múltiples factores de estrés que comprometen la funcionalidad de su barrera intestinal y el equilibrio de su microbiota intestinal.
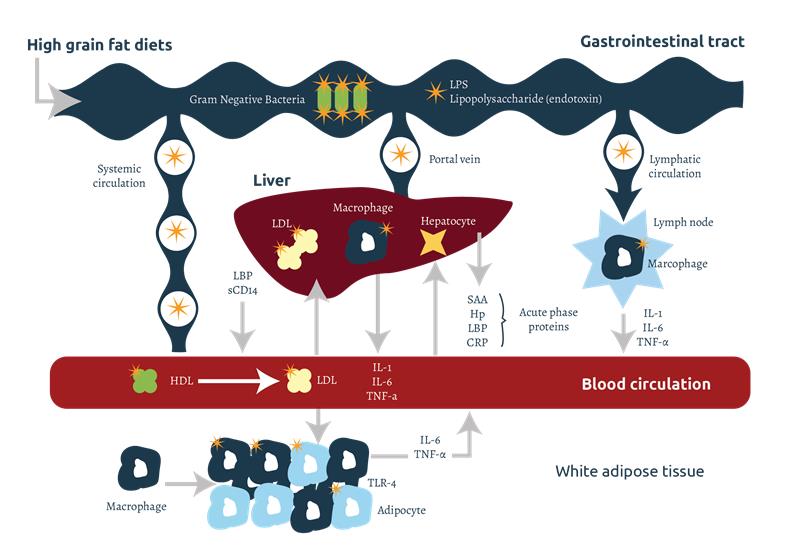
Las endotoxinas liberadas a nivel intestinal pueden pasar a la circulación sistémica y linfática por transporte transcelular, a través de endocitosis mediada por receptores presentes en las células epiteliales. Durante la digestión intestinal de las grasas de la dieta, la formación de micelas también facilita la permeabilidad de los LPS (véase la figura 2).
Interacción entre endotoxinas y otros factores patógenos
Otros factores que pueden aumentar la absorción de endotoxinas del TGI al torrente sanguíneo son: los radicales libres de oxígeno (ROS) y las micotoxinas.
De forma normal, las células del organismo animal generan ROS como resultado de los procesos metabólicos. Los ROS son compuestos altamente reactivos que pueden inducir la oxidación de moléculas intra y extracelulares que afectan directamente a la viabilidad y la función celular. En una situación ideal, se establece un equilibrio entre los mecanismos de oxidación y antioxidantes salvaguardando la integridad y la salud celular. Sin embargo, durante periodos de estrés como el destete, el disconfort térmico, la presencia de vomitoxina (DON) y otros factores estresantes, la producción de ROS puede exceder la capacidad natural del organismo para desintoxicarlos, lo que genera estrés oxidativo.
El TGI se ve muy afectado por el estrés oxidativo. Los niveles elevados de ROS son capaces de oxidar componentes celulares fundamentales (proteínas, ADN, lípidos, hidratos de carbono), induciendo la apoptosis de las células intestinales y dando lugar a una menor capacidad de absorción (vellosidades más cortas). Las uniones estrechas entre enterocitos impiden el paso de macromoléculas desde la luz intestinal al torrente circulatorio. En situaciones de estrés oxidativo, los ROS provocan una menor expresión de los genes que codifican las proteínas de las uniones estrechas. Como resultado, las uniones estrechas se disocian, aumentando la permeabilidad intestinal y permitiendo el transporte paracelular (entre enterocitos) de patógenos, LPS y toxinas. En estos casos, se puede producir un gran paso de LPS hacia el torrente circulatorio y linfático, desencadenado una respuesta inmune. Esta respuesta inmunológica generará inflamación, aumento permeabilidad intestinal, alteraciones digestivas, fiebre, reducción del consumo y empeoramiento de los rendimientos de los lechones. Si se supera la capacidad de detoxificación del organismo, los LPS puede causar inflamación sistémica, shock séptico, endotoxemia, fallo multiorgánico y la muerte del animal.
Metabolismo de las endotoxinas
Las endotoxinas liberadas en el organismo se unen a proteínas transportadoras presentes en las células y los fluidos corporales, que facilitan su transporte, reconocimiento y degradación. Existen varios tipos de proteínas transportadoras, como la sCD14 y las lipoproteínas, aunque las más conocidas son las proteínas de unión a lipopolisacáridos (LBP). El complejo LPS-LBP es reconocido por los correceptores CD14 presentes en la membrana celular de células inmunitarias como macrófagos, monocitos y neutrófilos. La sCD14 es una proteína transportadora que se encuentra en forma soluble y que permite la activación de otras células que no presentan CD14 en su membrana celular, como las células endoteliales y epiteliales, las células dendríticas, los fibroblastos y las células musculares lisas.
El complejo LPS-LBP-CD14 o sCD14 es reconocido por el receptor Toll-like 4 (TLR4), presente en la membrana de miocitos, adipocitos, células inmunitarias y epiteliales. A continuación el CD14 reacciona con el TLR4 en la membrana celular, que, a su vez, se une a la proteína MD-2 y genera una señal intracelular que estimula la respuesta inflamatoria. La señal activa el factor nuclear-κB (NF-κB), la transcripción de genes y la producción de citocinas, incluidas la interleucina 1 y 6 (IL-1 e IL-6) y el factor de necrosis tumoral alfa (TNFα). Las citocinas liberadas estimulan la quimiotaxis (la atracción de otras células inmunitarias a la zona para reforzar la respuesta inmunitaria) y la proliferación y diferenciación de los leucocitos. El TNF puede producir apoptosis (muerte celular programada). El TNFα estimula la secreción de IL-1 e IL-6 por parte de los macrófagos, potenciando la respuesta. Las interleucinas también estimulan la diferenciación y proliferación de los linfocitos B que producen inmunoglobulinas (Ig), especialmente IgM e IgG. La señalización termina con la endocitosis y la degradación del TLR4 y el LPS.
Función del hígado en la detoxificación de las endotoxinas
El hígado es el órgano más importante implicado en la detoxificación de las endotoxinas. La liberación y presencia de citocinas en la sangre estimulan a los hepatocitos del hígado para que produzcan proteínas de fase aguda (APP) como la LBP, la haptoglobina (Hp), la proteína C reactiva (CRP), la proteína de fase aguda mayor del cerdo (pig-MAP) y el amiloide sérico A (SAA). Los LPS pueden pasar al hígado desde la sangre y la linfa, a través de la vena porta, donde serán detoxificados, principalmente por la acción enzimática de la lipasa aciloxiacil hidrolasa (AOAH). La AOAH se encuentra en las de kupffer del hígado, pero también está presente en macrófagos, células dendríticas, neutrófilos y células de los túbulos renales corticales. Los LPS también pueden excretarse del hígado al duodeno a través de la bilis, donde se detoxifican por el efecto detergente de las sales biliares en el intestino. Los quilomicrones, lipoproteínas implicadas en el transporte de triglicéridos, desempeñan un papel importante en la unión del LPS y facilitan su contacto con la bilis, reduciendo su toxicidad.
Las LBP pueden catalizar la transferencia de LPS a lipoproteínas de alta densidad (HDL) para favorecer su eliminación a través del hígado. Estos LPS unidos a HDL se transferirán a lipoproteínas de baja densidad (LDL) que se unirán a los receptores LDL de los hepatocitos, produciendo su endocitosis y eliminación. También se forman complejos quilomicrón-LPS-LBP que reducen la toxicidad del LPS y facilitan su posterior reconocimiento y detoxificación por las LDL y los receptores LDL de los hepatocitos.
Si los niveles de LPS son elevados, las citocinas inflamatorias (IL-1 e IL-6) pasan de la circulación sistémica al hipotálamo, donde estimulan la producción de prostaglandinas, induciendo fiebre y un aumento de los neutrófilos circulantes.
Efectos de las endotoxinas
Las endotoxinas son reconocidas como un cuerpo extraño y activan una respuesta inmunitaria. Los niveles normales de endotoxinas serán combatidos por el lechón y no inducirán ningún signo clínico. Sin embargo, la respuesta inmune requiere nutrientes y energía que no pueden utilizarse para el crecimiento magro de los animales, lo que reduce su rendimiento y eficiencia alimentaria. Dependiendo de la intensidad de la respuesta inmunitaria, las citocinas liberadas producen efectos en el metabolismo del lechón, pasando a un estado catabólico, para generar los aminoácidos y la energía necesarios para mantener la proliferación de células inmunitarias, la síntesis de APP y la fiebre. Al mismo tiempo, la digestión y absorción de nutrientes en el intestino se verán afectadas. La acción de las citocinas sobre las células endoteliales provoca una reacción inflamatoria local caracterizada por el edema de la submucosa intestinal. El edema puede evolucionar a hemorragia y necrosis (muerte tisular). Esto compromete aún más las uniones estrechas y su función de barrera. La reducción del consumo y el aumento del cortisol inducido por las citocinas pueden aumentar la penalización del rendimiento. El cortisol promueve la degradación de proteínas y lípidos, empeorando aún más el rendimiento de los lechones.
La toxicidad producida por las endotoxinas depende del tipo de LPS, la vía de entrada, su concentración y la duración de la exposición. Los efectos tóxicos también dependen de la especie y de la sensibilidad individual del animal, así como de la presencia de otras enfermedades infecciosas que puedan agravar la situación.
Durante el proceso, también se liberan otras citocinas y enzimas que, junto con la IL-1 y la IL-6, pueden causar daño vascular y coagulación intravascular. En casos graves, cuando se sobrepasa la capacidad de detoxificación, puede producirse inflamación sistémica, shock séptico y endotoxemia, lo que puede conducir a un fallo multiorgánico y a la muerte del animal. La sepsis y la endotoxemia se caracterizan por fiebre, coagulación sanguínea intravascular, hipertensión pulmonar profunda, hipotensión arterial sistémica, disminución del gasto cardíaco, aumento reflejo de la frecuencia cardíaca y respiración acelerada.
Los síntomas clínicos de los lechones endotoxémicos comienzan con tos recurrente, salivación excesiva e incluso diarrea y vómitos. A continuación, su estado se deteriora, manifestando malestar generalizado, fiebre, renuencia a moverse y decúbito, mostrando dificultad respiratoria grave (disnea) y una coloración azulada de la piel (cianosis) hasta la muerte.
Medidas de control y prevención frente a las endotoxinas
Las medidas para contrarrestar las endotoxinas incluyen aquellas destinadas a reducir la presencia de bacterias gramnegativas, así como medidas directas para inactivar la acción de las endotoxinas. Las medidas destinadas a reducir la contaminación por bacterias gramnegativas incluyen acciones para reducir su carga ambiental, como la implementación de protocolos de bioseguridad, la optimización de las prácticas de limpieza y desinfección, la ventilación adecuada de las instalaciones para reducir el polvo y la garantía de acceso a agua potable, entre otras. Además, deben incluirse todas aquellas estrategias nutricionales que prevengan la disbiosis intestinal y la proliferación de bacterias gramnegativas, como el uso de ácidos, prebióticos y/o probióticos en los piensos, el aumento de la digestibilidad de los nutrientes, formulaciones con niveles adecuados de aminoácidos, proteína bruta, fibra y carbohidratos fermentables, entre otros componentes esenciales.
Asimismo, es esencial reducir los factores de estrés y adaptar al lechón a una dieta sólida antes del destete mediante un programa nutricional adecuado. La utilización de fuentes de fibra que mejoren la integridad intestinal y el uso de antioxidantes pueden ser otras estrategias complementarias.
Las medidas para reducir la acción directa de las endotoxinas son muy limitadas. El uso de vacunas contra las endotoxinas se ha probado con resultados prometedores en humanos, pero su uso en producción animal es muy limitado debido a su elevado coste. Otra opción es el uso de adsorbentes de endotoxinas en el tracto gastrointestinal. Este método sigue el mismo razonamiento que los adsorbentes de micotoxinas, ampliamente conocidos en la producción animal. Los adsorbentes de endotoxinas se añaden a los piensos y capturan las endotoxinas en el tracto gastrointestinal, impidiendo su acción local en la mucosa gastrointestinal y su absorción hacia el torrente sanguíneo y sus efectos sistémicos. La selección de un producto adsorbente de endotoxinas con datos científicos probados in vitro e in vivo puede ser una estrategia eficaz a un coste muy razonable.
Referencias disponibles previa petición