Por Kobe Lannoo, Global lead swine
En los últimos 25 años, la industria de piensos para animales ha desarrollado diversas alternativas a los antibióticos. Aunque se dispone de fragmentos de información para comparar los candidatos, pocos estudios han evaluado los principales candidatos utilizando la misma plataforma. Una excepción es el trabajo de Neath, Portocarero y Jones (2021). Determinaron la concentración mínima inhibitoria (CMI) de 34 compuestos frente a 5 importantes patógenos porcinos mediante ensayos de microdilución en caldo, con resultados interesantes.
¿Ensayo microbiológico?
Los materiales de prueba se mezclaron primero en caldo Mueller-Hinton II que contenía un 0,4 % de polisorbato 80, un emulsionante. Este material inicial se utilizó para realizar una serie de diluciones dobles en placas de 96 pocillos. Posteriormente, se añadió el microbio de prueba a cada pocillo a una concentración de aproximadamente 1,5*108 unidades formadoras de colonias con el emulsionante de nuevo para mantener la misma concentración. A continuación, las muestras se incubaron durante la noche. Tras la incubación, se contó el número de bacterias mediante ensayos colorimétricos.
Los microbios incluidos en la prueba fueron (y las abreviaturas utilizadas):
- Staphylococcus aureus (estafilococo)
- Streptococcus suis (estreptococo)
- Actinobacillus pleuropneumoniae (antes llamado Haemophilus pleuropneuomiae) (Actino)
- Salmonella Typhimurium (Salmo)
- Escherichia coli (E. coli)
Los valores de MIC oscilaron entre 0,49 y >31,25 mg/ml (31,25 mg/ml fue la concentración más alta analizada).
Cabe señalar que no se controló el pH en estas incubaciones. El pH osciló entre 3,5 para el formiato y aproximadamente 9 para el butirato; estos extremos pueden afectar al crecimiento microbiano. Dado que el pH in vivo está muy controlado por el huésped, es posible que estos efectos del pH no persistan en el animal.
¿Emulsionantes?
La metodología utilizada incluye un emulsionante, el polisorbato 80. El uso de emulsionantes es bastante común en este tipo de ensayos (por ejemplo, Houf, Batovska, Kovanda). Estos emulsionantes se consideran necesarios, ya que no todas las moléculas de prueba se mezclan con el agua. Por ejemplo, el autor principal del artículo de Neath indicó que el C12 no podía analizarse sin un emulsionante, ya que flotaría en la superficie del caldo de incubación y, por lo tanto, no dañaría los microbios. Sin embargo, esto significa que se utilizan procedimientos de ensayo in vitro que NO imitan por sí mismos lo que ocurre en el animal. A veces se añaden emulsionantes a los piensos para animales, pero esto se hace para aumentar la digestión de las grasas, no para potenciar los efectos antimicrobianos de los aditivos alimentarios. El propio animal también secreta ácidos biliares en el intestino delgado, que son emulsionantes muy potentes. Sin embargo, la bilis no suele estar presente en el estómago, donde los componentes de la prueba pueden tener la mayor parte de su actividad. Por lo tanto, debemos ser críticos con lo que significan en la práctica los resultados de las moléculas poco solubles.
Moléculas de prueba
Para simplificar la tabla, se ha omitido la forma ácido/sal en la lista de compuestos de prueba. En el caso de varios productos, se incluyó más de una forma en la prueba, pero la generalización no afectó significativamente a los resultados. Por lo tanto, se indican los valores medios. Las moléculas de prueba fueron (y las abreviaturas utilizadas):
Ácidos grasos libres/de cadena media:
- Butirato (C4)
- Caproato o hexanoato (C6)
- Caprilato u octanoato (C8)
- Cáprico o decanoato (C10)
- Laurato (C12)
- Mezclas de MCFA
Aceites esenciales:
- Alfa pineno
- Beta pineno
- Eugenol
- Aceite de orégano
- Aceite de galanga
- Terpeno
- Metoxibenceno
- Monoterpeno
Monoglicéridos:
- Monopropionato (mC3)
- Monobutirato (mC4)
- Monovalerato (mC5)
- Monocaprilato (mC6)
- Monopelargonato o monononanoato (mC9)
- Monolaurato (mC12)
- Mezcla de monoglicéridos
Otros:
- Glicósido A
- Glicósido B
- Óxido de zinc
- Ácido benzoico
- Ácido fórmico
Presentación de datos
En la publicación original, los resultados se presentan en valores de CMI en mg/ml: cuál es la concentración más baja a la que el compuesto sigue siendo activo, por ejemplo, a 0,001 g/ml. Esta forma de presentación es técnicamente correcta, pero visualmente difícil; en un gráfico, da como resultado barras muy pequeñas que son las más interesantes. Como las barras pequeñas se ocultan fácilmente en una imagen con mucho contenido, se decidió invertir los números. Así, los datos se presentan en ml/mg: cuál es la dilución máxima de una molécula a la que aún inhibe el crecimiento microbiano. Por lo tanto, 0,001 g/ml cambia a 1000 ml/g; 1 gramo de activo puede diluirse 1000 veces y, en ese punto, aún inhibe el crecimiento de un microbio. Una segunda ventaja es que las moléculas que en la prueba no lograron inhibir el crecimiento pueden representarse como 0.
Ácidos grasos
Se observó un fuerte efecto de la longitud de la cadena de ácidos grasos (figura 1). Tanto el C6 como el C8 tuvieron efectos antimicrobianos razonables a buenos para todos los microbios analizados, mientras que el C10 fue muy eficaz contra el estreptococo. En el caso del C10 y el C12, también se observó una inhibición razonable del crecimiento del estafilococo. Los efectos observados para el C4 se dieron en concentraciones que los hacen prácticamente irrelevantes.
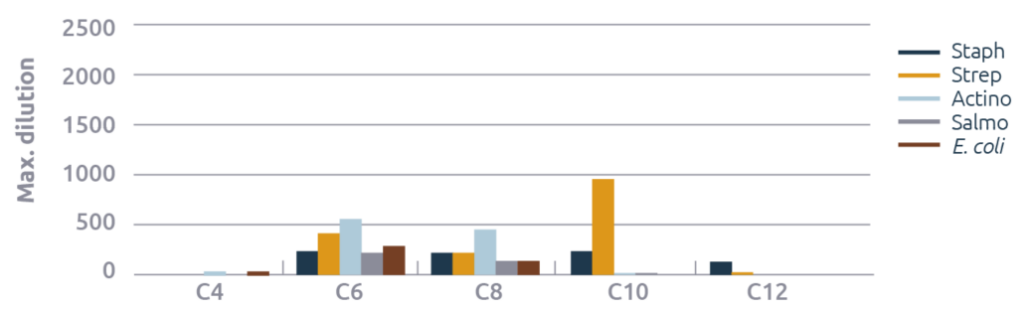
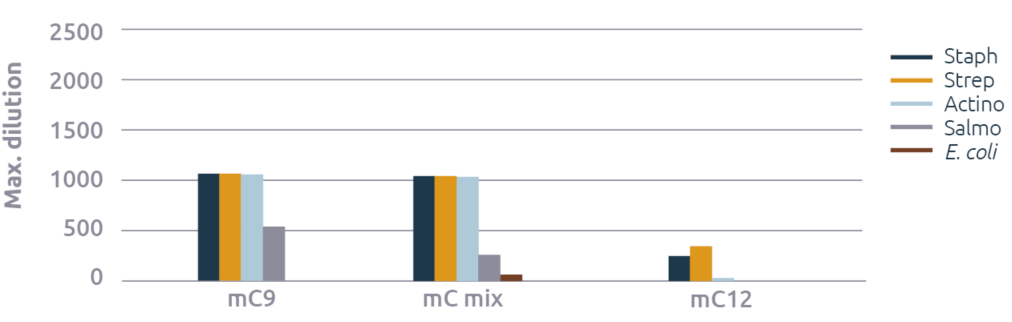
Monoglicéridos
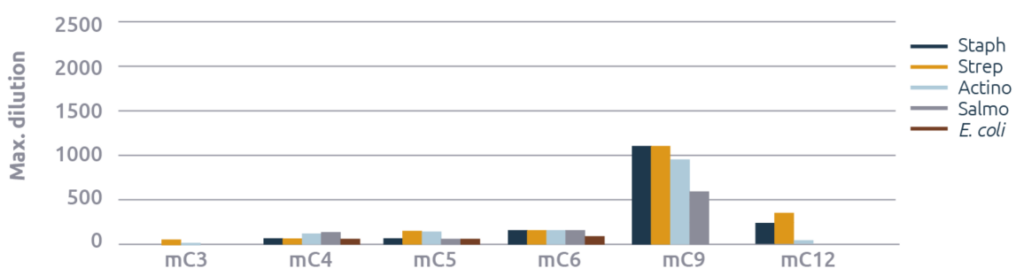
También se observó un fuerte efecto de la longitud de la cadena de ácidos grasos en los monoglicéridos (figura 2). El MC9 tuvo el efecto antimicrobiano más fuerte, excepto contra E. coli, contra la cual el mC5 y el mC6 tuvieron una eficacia débil. Los resultados observados con el mC12 no concuerdan con las afirmaciones comerciales realizadas. Su actividad se limita al estafilococo y al estreptococo, para los que obtuvo una puntuación razonable.
Aceites esenciales y otros compuestos
El alfa y beta pineno, el metoxibenceno y los glucósidos A y B no lograron inhibir el crecimiento microbiano. El óxido de zinc solo tuvo un efecto débil contra Actino, lo que respalda la idea de que el óxido de zinc es un modulador inmunológico más que un compuesto antimicrobiano. El aceite de galanga también inhibió débilmente solo a Actino. Por lo tanto, sus datos no se muestran. El formiato, el orégano, el eugenol, el ácido benzoico y el monoterpeno mostraron una actividad antimicrobiana razonable a excelente (figura 3). En el caso del formiato, el efecto del pH mencionado anteriormente puede contribuir a su fuerte efecto antimicrobiano, y la pregunta es qué efectos tiene la molécula en los segmentos del tracto digestivo donde el animal controla el pH.
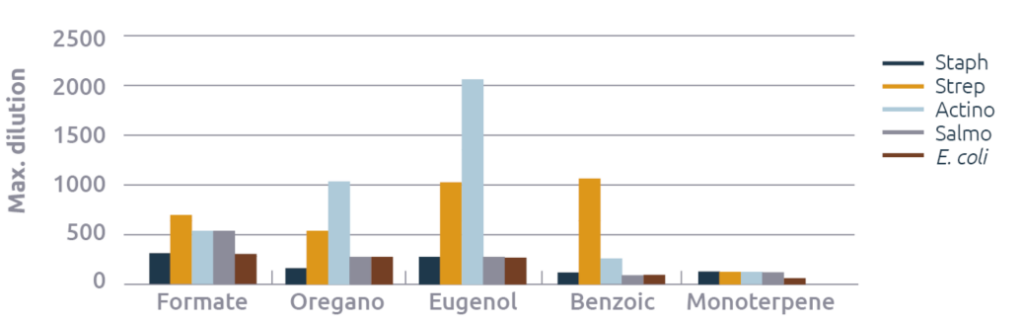
Prueba de sinergia
La prueba también incluyó mezclas de MCFA y mezclas de monoglicéridos (figura 4). Estos datos muestran que las mezclas de MCFA mejoraron sus efectos antimicrobianos en comparación con los MCFA individuales: ¡los valores máximos de dilución de las mezclas A y B de MCFA fueron, en promedio, tres veces más fuertes que los de C8 y C10! Por lo tanto, con mezclas optimizadas se puede obtener una eficacia mucho mayor que con MCFA individuales.
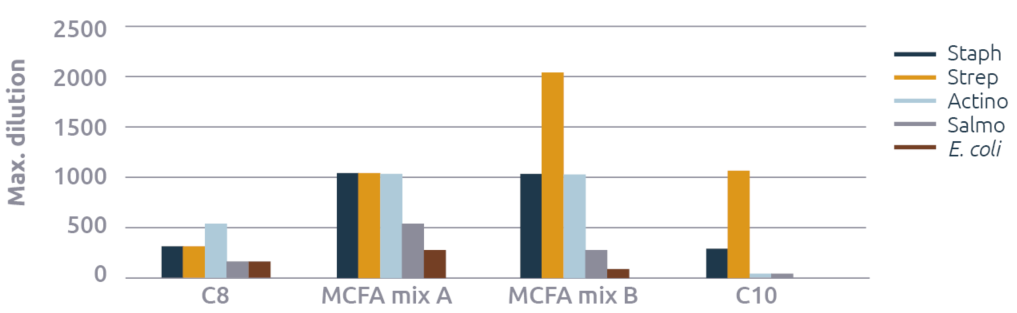
En el caso de los monoglicéridos, la prueba de sinergia es menos convincente (figura 5). La excepción es contra E. coli, donde la mezcla de monoglicéridos es apenas eficaz, mientras que mC9 o mC12 no tuvieron ningún efecto.
Y el ganador es…
El promedio de los valores de CMI para los diferentes microbios dio como resultado la siguiente clasificación de productos:
1) Mezcla MCFA A
2) Formato
3) Eugenol
4) C6
5) Orégano
6) Mezcla MCFA B
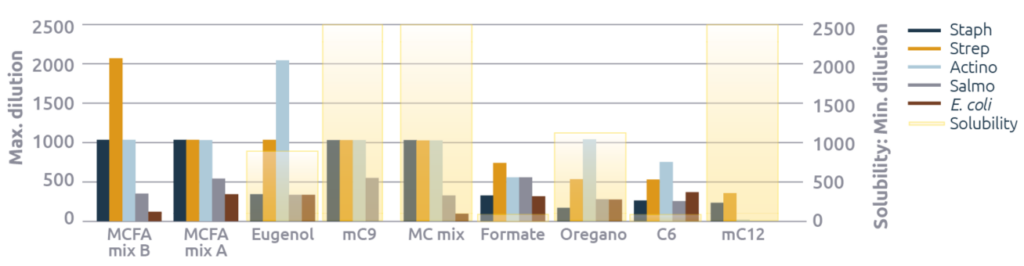
Esta comparación vuelve a poner de relieve las ventajas de los cócteles de MCFA para controlar las bacterias potencialmente patógenas relevantes para la producción porcina. Es una pena que no se hayan probado los cócteles de C6 y C8, ya que estos datos sugieren que dichos cócteles podrían ser los más eficaces.
Anteriormente se ha destacado que se utilizó un emulsionante para permitir que las moléculas difíciles de disolver afectaran a las bacterias, ya que, de lo contrario, simplemente flotarían en la superficie del líquido de los recipientes de incubación. En el gráfico siguiente se muestran los límites de solubilidad de las distintas moléculas de prueba en forma de barras rojas. Estos datos de solubilidad se muestran como un factor de dilución mínimo: ¿cuál es la proporción mínima de agua por molécula para conseguir su completa solubilización? Por ejemplo, el formiato tiene una solubilidad de 0,00139 g/ml, por lo que debe diluirse al menos 72 veces (1/0,00139). En la figura 6 se han incluido estos factores de dilución mínimos para los distintos productos de prueba. Las barras correspondientes se desvanecen deliberadamente hacia la parte superior; los datos utilizados para calcular los factores de dilución mínimos son para disolver moléculas en agua pura. En el tracto intestinal tenemos un entorno mucho más complejo y hay muchos factores que influyen en la solubilidad real de las moléculas. Por lo tanto, cuando nos acercamos al límite de solubilidad en agua, es posible que las moléculas de prueba ya sean totalmente solubles, por ejemplo, en el entorno del estómago (pero también puede ocurrir lo contrario, que la solubilidad sea mucho menor que en agua pura). Por lo tanto, no debemos considerar la solubilidad en agua como una división clara, sino como una indicación.
Además de la solubilidad, existe un segundo factor limitante: la inclusión máxima del producto en el pienso. Los aditivos se dosifican generalmente en menos del 1 % del pienso. El pienso consumido se diluye normalmente con agua potable en una proporción de aproximadamente 2,5:1 y, además, se diluye con la saliva y otros líquidos secretados en el tracto digestivo. Por lo tanto, un aditivo para piensos dosificado al 1 % o 10 g/kg de pienso se distribuirá en al menos 2500 g de agua, lo que supone un factor de dilución de 250. Dado que la ingesta de agua y pienso no están necesariamente sincronizadas (excepto en el caso de la alimentación líquida), tampoco debemos considerar este factor de 250 como algo rígido, sino como una indicación. Sin embargo, es poco probable que los umbrales máximos de dilución inferiores a 100 tengan relevancia práctica.
The data imply that for MCFA mix B, solubility but also the inclusion rate in the feed will likely prevent it from being effective against E. coli, this as the red bar is higher (at 357) than the maximum dilution threshold for E. coli (64) but also as a maximum dilution rate 64 can’t be achieved with the normal inclusion in the feed. For the other four microbes solubility is not a limiting factor. From that perspective, MCFA mix A may actually do better in practice than MCFA mix B: its’ activity against E. coli is higher and close enough to the solubility threshold such that it may still work in practice, while it does an excellent job against Staph, Strep, and Actino, and a good job against Salmo.
El tercero en la clasificación fue el eugenol. El eugenol tiene un olor fuerte que afecta a su estabilidad, lo que dificulta su uso en la práctica. Además, su solubilidad es límite para tres de los microbios evaluados. MonoC9 (monopelargato) y la mezcla de monoglicéridos obtuvieron técnicamente el cuarto y quinto puesto. Los datos de solubilidad del monoC9 no estaban disponibles en la base de datos consultada (Pubchem, Sellekchem), pero dado que el monoC8 y el monoC10 tienen una solubilidad muy baja, se supone que tanto el monoC9 como la mezcla de monoglicéridos son poco solubles. Por lo tanto, los datos de CMI obtenidos son bastante teóricos y requieren verificación en condiciones que imiten las del estómago, donde normalmente los emulsionantes no están presentes en altas concentraciones.
El formiato ocupó el sexto lugar, y sus efectos ciertamente no se ven obstaculizados por la solubilidad. Sin embargo, el formiato redujo el caldo de incubación a un pH de 3,5, y la pregunta es cuáles de sus efectos son resultado de la molécula de formiato y cuáles se deben al pH. En los animales, el pH se ve afectado por la dieta en la que interviene el aditivo, pero también en gran medida por el propio animal, por lo que la gran pregunta es qué sucederá en el animal.
En el caso del orégano, los ingredientes clave son el carvacrol y el timol. El carvacrol tiene una solubilidad muy baja y a menudo se clasifica como insoluble. El timol tiene una solubilidad razonable y, por lo tanto, la solubilidad que se muestra en la figura 6 es solo para el timol, lo que técnicamente es incorrecto, ya que no es el producto que se ha probado. Basándose en la solubilidad del timol, cabría esperar que las propiedades antimicrobianas del orégano en la práctica resultaran decepcionantes.
El mC12 no se situó entre los 10 primeros, pero como se promociona mucho como una alternativa mejor al MCFA, se incluye en el gráfico para compararlo. Para ser eficaz, requirió una concentración 10 veces mayor que el C6 y el C8 y 20 veces mayor que la combinación C8/C10. No tuvo eficacia contra Salmo y E. coli y tuvo poca actividad contra Actino. Esta imagen empeora aún más si se tiene en cuenta la solubilidad del mC12, ya que su escasa solubilidad le impide alcanzar las concentraciones necesarias para ser antimicrobiano. Por lo tanto, cualquier efecto antimicrobiano solo se observará cuando el mC12 se emulsione, algo para lo que las formulaciones de los piensos no están optimizadas de forma habitual.
Las referencias están disponibles previa solicitud.