Mikotoksyny i endotoksyny są naturalnie występującymi toksynami stanowiącymi poważne zagrożenie dla produkcji zwierzęcej. Wiele niebezpiecznych objawów takich jak nieszczelność jelit, zmiany w jamie ustnej, uszkodzone kosmki – jest związanych ze zdolnością toksyn do wywoływania stresu oksydacyjnego u zwierząt, co negatywnie wpływa na wydajność i zdrowie.
Różne rodzaje toksyn
Mikotoksyny są związkami toksycznymi naturalnie wytwarzanymi przez niektóre rodzaje pleśni (grzybów). Rozwój pleśni występuje zazwyczaj w ciepłych i wilgotnych warunkach. Można je znaleźć w samej paszy, rozwijają się przed lub po zbiorach a także tworzą się podczas przechowywania. Grzyby pleśniowe rosną na wielu środkach spożywczych – takich jak zboża, suszone owoce, orzechy i przyprawy – a gdy są narażone na działanie czynników zewnętrznych, mogą wytwarzać wtórne metabolity zwane mikotoksynami. Większość mikotoksyn jest stabilna chemicznie i może przetrwać proces przetwarzania żywności. Ogólnie znane objawy zarażenia mikotoksynami u zwierząt gospodarskich to wymioty, zmniejszone spożycie paszy, obniżony wzrost, obniżona odporność, problemy z płodnością i zwiększona śmiertelność.
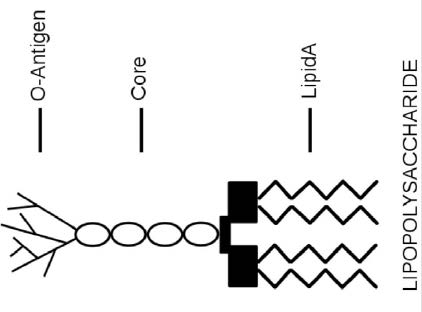
Endotoksyny to lipopolisacharydy (LPS), które są składnikami strukturalnymi bakterii Gram-ujemnych. Stanowią one część błony zewnętrznej i są uwalniane głównie wtedy, gdy bakterie ulegają procesowi lizy – ściana komórkowa ulega rozpadowi – w wyniku działania antybiotyków lub odpowiedzi immunologicznej. LPS składa się z trzech elementów (Rysunek 1): Lipid A (składnik hydrofobowy, który służy jako kotwica, gdy bakteria atakuje komórkę gospodarza), rdzeń ang. core (oligosacharyd) oraz O-antygen (składnik hydrofilowy wystający do przestrzeni zewnątrzkomórkowej nienaruszonych komórek bakterii). Badania wykazały, że lipid A jest odpowiedzialny za większość schorzeń powodowanych przez endotoksyny. Powszechne objawy działania endotoksyn obejmują reakcję zapalną prowadzącą do gorączki i biegunki.
Mechanizmy działania
Po spożyciu paszy skażonej mikotoksynami, przewód pokarmowy to pierwsze miejsce, które jest narażone na ich oddziaływanie. Wpływ mikotoksyn na komórki nabłonka powoduje zmienioną produkcję śluzu, zmienioną produkcję cytokin, zmniejszoną proliferację komórek i zaburzoną funkcję bariery jelitowej. Po przejściu przez komórki nabłonka mikotoksyny są wchłaniane przez krew i transportowane do wątroby. W wątrobie są one metabolizowane do metabolitów wtórnych. Na przykład, aflatoksyna B1 jest przekształcana w aflatoksynę M1, a zearalenon (ZEA) jest zwykle przekształcany w α-ZEA i β-ZEA. W wątrobie mikotoksyny są dalej metabolizowane. Na przykład α-ZEA jest 100 razy bardziej toksyczny niż jego pierwotna forma. Po przejściu przez wątrobę mikotoksyny są rozprowadzane po całym organizmie, wpływając na układ odpornościowy i wszystkie narządy.
Endotoksyny zwykle nie są obecne w paszy, ale są produkowane w przewodzie pokarmowym w przypadku nadmiernego wzrostu bakterii gram-ujemnych. Fizjologiczne działania LPS są wywoływane głównie przez składnik lipidowy A LPS. Lipid A jest silnym modyfikatorem odpowiedzi biologicznej, który może stymulować układ odpornościowy ssaków. LPS stymulują miejscowy lub ogólnoustrojowy stan zapalny poprzez aktywację receptorów. Dodatkowo, LPS i związany z nim stan zapalny mogą regulować funkcję nabłonka jelitowego poprzez zmianę integralności bariery nabłonkowej, jak również transportu i wykorzystania składników odżywczych.
Indukcja stresu oksydacyjnego
Szkodliwe działanie zarówno endotoksyn, jak i mikotoksyn ma pewne wspólne elementy. Jednym z nich jest wywoływanie stresu oksydacyjnego. W normalnych warunkach, wolne rodniki lub „reaktywne formy tlenu” (ROS) są wytwarzane jako część standardowego procesu metabolicznego. Te wysoce niestabilne i chemicznie reaktywne cząsteczki są szybko eliminowane przez naturalny system antyoksydacyjny w celu uniknięcia potencjalnych szkód w organizmie. Jednak w przypadku ekspozycji na mikotoksyny i/lub endotoksyny, stężenie komórkowych ROS przekracza poziom naturalnie występujących antyoksydantów, co powoduje stres oksydacyjny. Nadmiar ROS wywołuje szkodliwą reakcję łańcuchową, powodując zniszczenie kwasów nukleinowych, białek i lipidów. Ponieważ te składniki są podstawowymi molekułami dla wszystkich procesów metabolicznych, ROS bezpośrednio wpływają na żywotność komórek, zdrowie zwierząt i ich wydajność.
Stres oksydacyjny u zwierząt może być określany przy użyciu różnych parametrów, takich jak czas połowicznej hemolizy komórek krwi (HT50), poziom glutationu (GSH), poziom peroksydazy glutationowej (GSH-Px), poziom dialdehydu malonowego (MDA) lub aktywność dysmutazy ponadtlenkowej (SOD). Tabela 1 pokazuje wpływ poziomu stresu oksydacyjnego wywołanego przez mikotoksyny u prosiąt. Jak wskazują różne parametry krwi, prosięta narażone na maksymalny dozwolony w UE poziom zanieczyszczenia paszy DON (0,9 ppm) doświadczały większego stresu oksydacyjnego. Te wyższe poziomy stresu oksydacyjnego skutkowały niższym pobraniem paszy i zmniejszoną wydajnością wzrostu – negatywnie wpływając na rentowność produkcji.
| Kontrola negatywna | 0,9 ppm DON | |
| HT 50(min)*. | 90.92 | 87.51 (-3.8%) |
| GSH-Px, U/mg białka** | 6.26 | 6.62 (+5.8%) |
| MDA, nmol/g białka*** | 41.75 | 44.86 (+7.4%) |
* HT50 to czas wymagany do zniszczenia lub rozerwania 50% komórek krwi narażonych na atak wolnych rodników, mierzony testem KRL. Niższy HT50 wskazuje, że komórki krwi były narażone na wyższy poziom stresu oksydacyjnego.
** MDA we krwi jest produktem końcowym peroksydacji lipidów. Wyższe wartości MDA we krwi wskazują na większy stres oksydacyjny.
*** W swojej zredukowanej formie glutation może neutralizować wolne rodniki, przekształcając się w jego formę utlenioną. Im wyższy stosunek „glutationu utlenionego do glutationu całkowitego”, tym większy stres oksydacyjny, na który narażone było zwierzę.
Podobny wpływ na stres oksydacyjny wykazano w tabeli 2. Podanie LPS spowodowało obniżenie aktywności SOD i GSH- Px w jelicie czczym świń. Zaobserwowano istotnie większą (P < 0,05) zawartość MDA w błonie śluzowej jelita w grupie LPS w porównaniu z grupą kontrolną.
| Kontrola | LPS | |
| SOD, U/mg białka* | 95.85 +3.13a | 63.12 + 2.97b |
| GSH-Px, U/mg białka** | 72.11 + 3.51a | 53.99 + 3.26b |
| MDA, nmol/g białka*** | 0.95 + 0.16a | 1.51 + 0.25b |
a,b Różne litery w jednym rzędzie oznaczają różnice istotne statystycznie (P<0.001).
* SOD (dysmutaza ponadtlenkowa) jest enzymem antyoksydacyjnym odpowiedzialnym za rozpad rodników ponadtlenkowych na tlen i nadtlenek wodoru. Niższe wartości SOD wskazują na niższą zdolność antyoksydacyjną.
** GSH-Px (peroksydaza glutationowa) jest odpowiedzialna za redukcję nadtlenku wodoru do wody i tlenu. Niższe wartości tego enzymu oznaczają niższą aktywność antyoksydacyjną.
*** MDA w błonie śluzowej jelita grubego jest końcowym produktem peroksydacji lipidów. Wyższe wartości MDA wskazują na większy stres oksydacyjny.
Funkcja bariery jelitowej
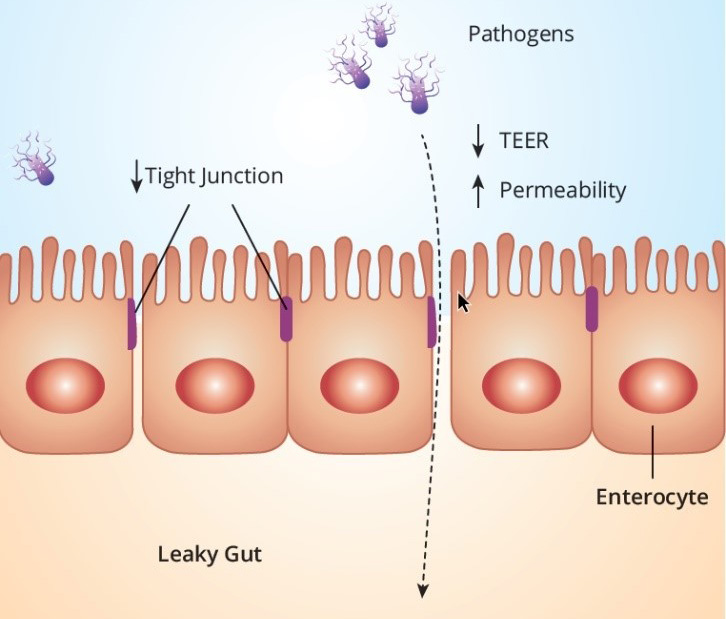
Po tym jak mikotoksyny i endotoksyny wejdą w kontakt z komórkami nabłonka lub zostaną wchłonięte, przewód pokarmowy jest w znacznym stopniu narażony na indukcję stresu oksydacyjnego. Oprócz negatywnego wpływu na wszystkie procesy komórkowe, stres oksydacyjny ma ogromny wpływ na funkcjonowanie bariery jelitowej (rysunek 2). Bariera jelitowa jest zbudowana z warstwy komórek nabłonkowych pokrytych śluzem. Białka ścisłego połączenia tworzą fizyczną barierę pomiędzy dwoma sąsiadującymi komórkami nabłonka, aby zapobiec paracelularnemu wchłanianiu niepożądanych substancji, takich jak toksyny lub patogeny. Pod wpływem wolnych rodników stres oksydacyjny uszkadza funkcję bariery jelitowej poprzez modyfikację białek komórkowych; zjawisko to jest powszechnie określane jako „nieszczelne jelito”. W badaniach ex vivo i in vitro, mierzących przeznabłonkowy opór elektryczny (TEER), wykazano, że DON i fumonizyna B1 zwiększają przepuszczalność warstwy nabłonka jelitowego świń i drobiu. Upośledzona funkcja bariery jelitowej skutkuje zwiększoną przepuszczalnością dla toksyn, patogenów i antygenów związanych z paszą. Jeśli chodzi o endotoksyny, Aschenbach i wsp. (2003), wykorzystali linie komórkowe nabłonka jelitowego i doszli do wniosku, że nieprawidłowy wzrost endotoksyn w świetle jelita indukuje apoptozę komórek, co następnie zaburza białko ścisłego połączenia zonula occludens-1, jak również zwiększa produkcję tlenku azotu, prowadząc do zwiększonej przepuszczalności błony śluzowej.
Przeciwdziałanie toksynom
Kontrola mikotoksyn zaczyna się na polu i w magazynie od kontroli jakości surowców. Jednakże, jak wykazały liczne badania, zanieczyszczenie paszy mikotoksynami jest nieuniknione. Ponadto, system zarządzania jakością nie pozwala uniknąć ryzyka związanego z endotoksynami, które są naturalnie produkowane w przewodzie pokarmowym zwierząt. Dlatego, aby wesprzeć zwierzę w radzeniu sobie z toksynami, potrzebna jest holistyczna strategia wiązania toksyn w celu zmniejszenia stresu oksydacyjnego i ochrony funkcji bariery jelitowej. Takie podejście umożliwia producentom pasz i hodowcom uniknięcie nadmiernego stresu oksydacyjnego spowodowanego przez miko- i endotoksyny, co skutkuje optymalną wydajnością i spokojem ducha.
Twój ekspert w dziedzinie Agrimprove
Masz pytanie lub potrzebujesz indywidualnej porady? Twój ekspert Agrimprove jest gotowy do pomocy. Skontaktuj się z nim bezpośrednio lub poproś o kontakt w dogodnym dla Ciebie terminie.
To również może Cię zainteresować
Gotowy do wprowadzenia usprawnień? Wypróbuj jedno z proponowanych przez nas rozwiązań o potwierdzonej wartości dodanej.
